自サイトの別記事をそのまま表示させる【WordPress】

作成済みの投稿記事や固定ページを別記事でそのまま表示したい場合があります。
そんな時に便利なのがショートコード。
プラグインはあまり使いたくないので、今回はfunction.phpにコードを追加します。
数行の追加のみで一度設定してしまえば、記事にショートコードを貼るだけで簡単に表示可能です。
プラグインを使わず別記事を表示する方法
function.phpにコードを追加
まずは、子テーマのfunction.phpにコードを追加します。
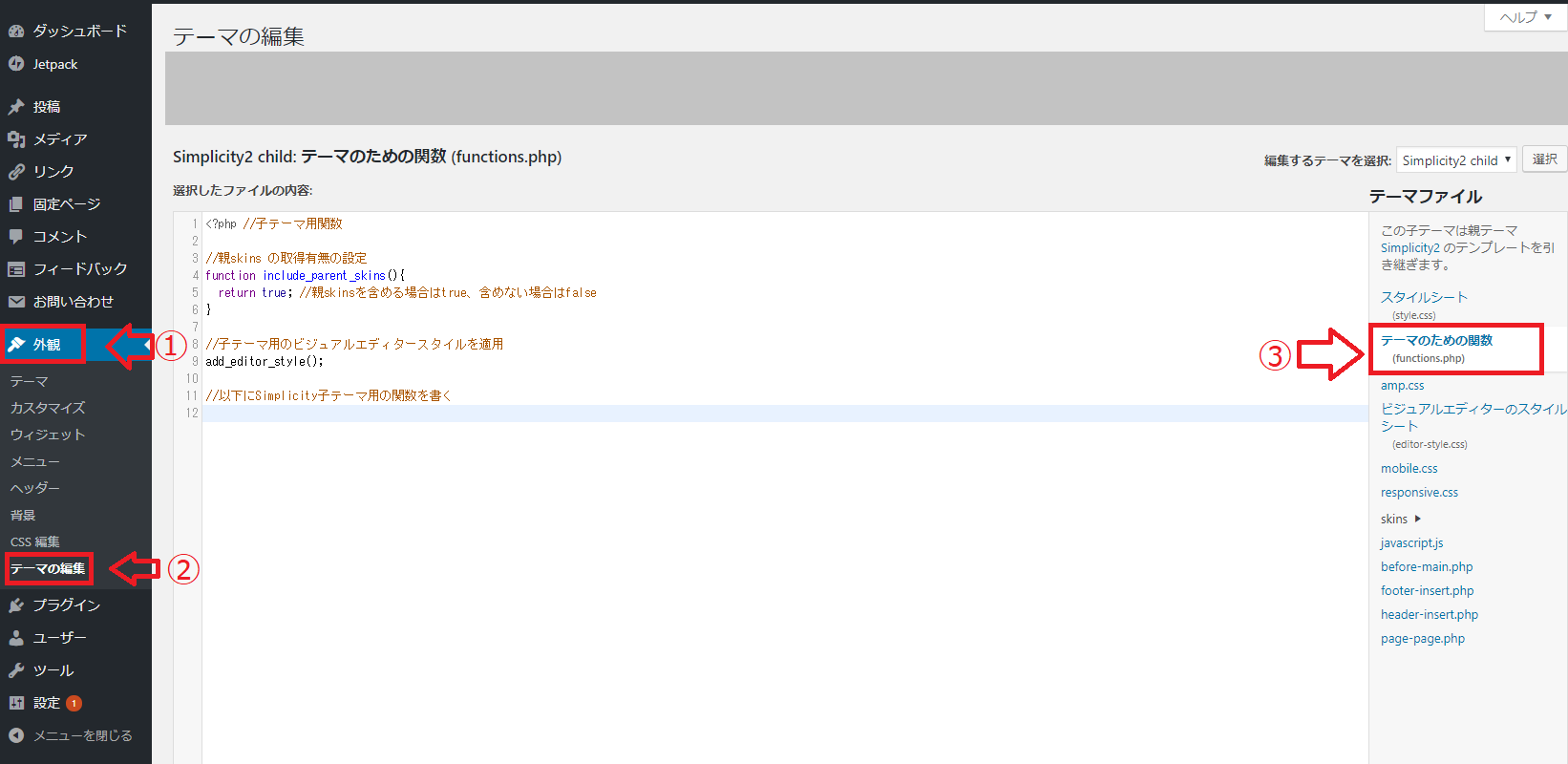
「外観」→「テーマの編集」→「テーマのための関数(function.php)」
追加するコード
//別記事挿入のショートコード
function text_insert($atts){
extract(shortcode_atts(array("id"=>0),$atts));
if(get_post($id)!=null)
return wpautop(do_shortcode(get_post($id)->post_content));
}
add_shortcode("s-text","text_insert");
上のコードを
<?php //追加するコード ?>
内に追加してください。(ない場合は <?php と ?> も追加)
記事にショートコードを入力
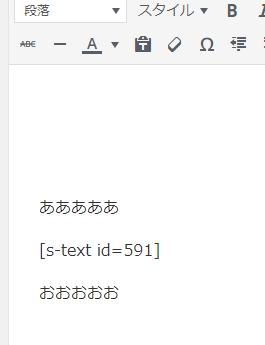
次に投稿記事、又は固定記事の表示したい箇所に次のコードを入力します。
[s-text id=591]
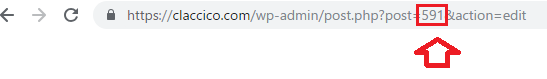
id=591の数字の部分は、postIDです。
挿入したい記事の編集ページのアドレス(URL)部分、post=〇〇の数字です。
固定ページで投稿記事どちらでも使用可能
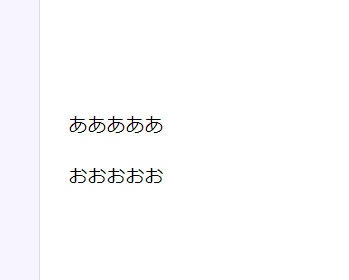
表示結果
挿入したい文章の間に[s-text id=591]を入力
このように表示されます。
コロナが起きる前からシェディングの効果は確認されている。
良い方にも悪い方にも転用可能。
プロテオーム解析から明らかになったシェディングの役割と制御機構膜タンパク質のシェディング感受性は生合成の過程で規定される
Published: 2018-12-20
生物はDNA, RNA,タンパク質,糖質,脂質といったさまざまな有機化合物で構成されているが,なかでも生命現象を生み出す原動力となるのはタンパク質である.タンパク質には,修飾を受けることで活性や局在がダイナミックに変化する,というほかの化合物にはない性質があるからである.膜タンパク質シェディング(以下シェディング)は,細胞膜に埋め込まれた膜タンパク質を切断し細胞外領域を可溶化するという,タンパク質の存在様式を不可逆に変換する影響力の強い修飾機構である(図1).本稿ではまずシェディングの生物学的な意義について説明し,続いて筆者の研究から明らかになったシェディングの役割や制御機構に関する知見を紹介する.
© 2018 公益社団法人日本農芸化学会
シェディングは膜タンパク質だけでなくそれを発現する細胞の機能をも制御する
細胞を包む脂質二重膜にはさまざまな機能をもった膜タンパク質が埋め込まれており,埋め込まれている膜タンパク質の種類によって細胞の性質が規定されると言っても過言ではない.特定のシグナル分子に対する受容体があればそのシグナル分子に反応できるし,特定の細胞外基質(コラーゲンなど)に接着する分子があればその細胞外基質のある場所に生着できる.したがって,細胞と外界とをつなぐインターフェイスである細胞膜に埋め込まれている膜タンパク質の種類と量は極めて厳密に制御される必要がある.
シェディングは膜タンパク質を細胞膜の近くで切断し細胞外領域(膜タンパク質のうち細胞の外にある部分)ほぼ全体を可溶化して放出するというタンパク質修飾機構である(図1).これまでにさまざまな膜タンパク質のシェディングが報告されているが,シェディングが及ぼす影響は切断される膜タンパク質の機能によって異なる.細胞外領域が別の細胞に増殖や炎症反応などを促すシグナル分子であれば,シェディングによってその分子が働ける場所は飛躍的に広がる(図2A).一方でそれらのシグナル分子に対する受容体がシェディングされると,細胞表面の受容体の数が減ることとなりシグナルは遮断される.また放出された可溶性の細胞外領域がシグナル分子と結合して無力化することもシグナルの遮断を増長する(図2B).また特定のタンパク質に接着する接着分子がシェディングされると,すでに存在する接着構造が破壊されるだけでなく,放出された可溶性の細胞外領域が接着構造の新たな形成を阻害するため,接着は相乗的に弱められる(図2C).さらには,シェディングによって細胞に残った切り株タンパク質がさらなる切断を受け,細胞内領域(膜タンパク質のうち細胞の内側にある部分)が可溶化して核へと移行し,遺伝子発現を調節する膜タンパク質があることも知られている(1, 2).つまりシェディングは,細胞膜に埋め込まれた膜タンパク質を切断することで,細胞内外の可溶性タンパク質を生み出すと同時にその機能をも変換するという,切断される膜タンパク質だけではなくそれを発現する細胞の機能をも制御する影響力の強い分子機構なのである.
シェディング酵素であるADAMファミリーの基質特異性
上記のような影響力の強さから,すべての膜タンパク質がやみくもにシェディングされることはなく,状況に応じた膜タンパク質だけが特異的にシェディングされるのだが,シェディングの特異性を生み出す分子機構には不明な点が多い.シェディングは主にADAM(a disintegrin and metalloprotease)ファミリーと呼ばれる一群のメタロプロテアーゼ(活性に亜鉛イオンを必要とするタンパク質切断酵素)によって担われる(1, 2).ADAMファミリーは細胞外領域に活性中心をもつ膜貫通型のプロテアーゼであり(図1,ハサミ),酵素も基質も膜タンパク質であるシェディングは膜に依存した酵素反応であるとも言える.哺乳類に30種類ほど存在するADAMファミリーの中で,シェディングを担う主なメンバーはADAM10(Kuzbanianとも呼ばれる)とADAM17(TACE(TNF alpha converting enzyme)とも呼ばれる)であり,どちらもあらゆる組織や細胞種に普遍的に発現しているが,それぞれが切断する膜タンパク質は異なり,ADAM10もしくはADAM17の遺伝子を破壊したノックアウトマウスの表現型も異なる.ADAM10ノックアウトマウスは,発生の初期の段階で細胞の運命決定にかかわるNotchという膜タンパク質のシェディングが起こらなくなりシグナルが遮断されるため胎生9.5日という早い段階で死亡する(3).一方,ADAM17ノックアウトマウスは,ADAM10ノックアウトマウスより長く生存するものの出生前後で死亡する(4, 5).直接の死因は肺・心臓・胎盤の形成不全であると考えられているがほかの臓器にも異常が見られ,いずれも細胞の増殖を促すシグナル分子EGF(epidermal growth factor)ファミリーからのシグナルが遮断されたマウスの異常と極めてよく似ている(4, 5).これらの結果は,マウス発生時にADAM10がNotchをADAM17がEGFファミリーを特異的にシェディングすることを示唆している.しかしながら,NotchやEGFファミリーと,成体内でADAM10とADAM17がシェディングすると報告されている複数の膜タンパク質と比較しても,アミノ酸配列上の類似も相違も見つからない.合致するように,ADAM10とADAM17のプロテアーゼ領域を人工的に合成し試験管内でペプチド基質を切断させても,それぞれが明確に好むアミノ酸配列は見つからない(6).つまりADAM10やADAM17が,アミノ酸配列を元に切断する膜タンパク質を見分けているとは考えにくく,シェディングの特異性を決める分子機構には不明な点が多いのである.
プロテオーム解析によるシェディングスクリーニング
筆者は,特定のシェディングにだけ注目した従来の解析方法ではなく,プロテオーム解析(コラム参照)によりシェディング全体をスクリーニングすれば,シェディングされる膜タンパク質同士の共通点やシェディングされない膜タンパク質との相違点が明らかとなり,シェディングの特異性を決める分子機構を解明できるのではないかと考えた.そして,免疫細胞マクロファージから放出されるサイトカインTNFα(tumor necrosis factor alpha)が膜に埋め込まれたタンパク質として生合成されシェディングされて初めて放出されること(7, 8)と,炎症反応時のマクロファージではTNFαを盛んに放出するためにシェディングが活性化することに着目し,炎症反応時のマクロファージからTNFαと同時にシェディングされ放出されるタンパク質をスクリーニングすることにした.図3に筆者が行ったシェディングスクリーニングの概略を示す.マクロファージに細菌の外壁成分であるLPS(lipopolysaccharide)を加えると炎症反応が起こりシェディングが活性化してタンパク質が放出される(図3,星).そこでLPSだけで刺激したマクロファージ(図3,上左)と,ADAMファミリー阻害剤の存在下でLPS刺激したマクロファージ(図3,上右)から放出されたタンパク質をすべて回収し,LPSだけで刺激したほうに多く含まれるタンパク質をスクリーニングすることにした.スクリーニングには,二次元電気泳動でタンパク質を分離した後,各タンパク質の量を蛍光強度で比較する2D-DIGE(two dimensional fluorescence difference gel electrophoresis)という方法を用いた(図3,下).スクリーニングの結果,複数の膜タンパク質がTNFαと同時にシェディングされ放出されることがわかったが,その中にはこれまでシェディングされることが報告されていなかったVIP36(vesicular integral membrane protein 36 kDa)という膜タンパク質が含まれていた(9).
VIP36は細胞外に糖鎖と結合するレクチン領域をもつ一回膜貫通型のタンパク質であり,小胞体やゴルジ体に存在することからこれらの小胞での糖タンパク質の輸送が主な役割であると考えられていた.そこで本当にVIP36がシェディングされ細胞外に放出されるのか細胞外領域にタグをつけたVIP36を用いて検討したところ,確かにVIP36の細胞外領域が放出されること,ADAMファミリーを阻害すると放出が抑制されVIP36が細胞表面に貯まることがわかり,VIP36が細胞表面にも存在しシェディングされて放出されることがわかった.さらに,VIP36の発現を抑制するとマクロファージによる大腸菌の貪食が弱まること,逆に野生型のVIP36を強制発現すると貪食が強まること,シェディングされない変異型のVIP36を強制発現しても貪食は変わらないことがそれぞれ明らかになった(9).これらの結果から,VIP36が小胞体やゴルジ体での糖タンパク質の輸送だけではなく,細胞表面でシェディングを介して貪食を活性化していることが示唆された.以上の研究を通じて,この方法で確かにシェディングをスクリーニングできることと,シェディングスクリーニングにより新しいシェディングとその役割を明らかにできることが証明された.
スクリーニングを用いたシェディングの細胞外刺激特異性の解析
次に,シェディングスクリーニングを用いてシェディングの刺激依存性を解析した結果を簡単に紹介したい.シェディングはスクリーニングに用いたLPSだけでなく発がんプロモーターであるTPA(12-O-tetradecanoylphorbol 13-acetate, PMA(phorbol 12-myristate 13-acetate)とも呼ばれる)やカルシウムイオノフォアといったさまざまな細胞外からの刺激で活性化するが,作用する細胞内シグナル伝達経路の異なるこれらの刺激がシェディングの活性化に集約される分子機構は不明であった.そこで筆者は異なる細胞外からの刺激で活性化するシェディングを比較すれば,それらの刺激がどの段階で集約されるのかわかるのではないかと考え,マクロファージにLPSもしくはTPAを加えたときに活性化するシェディングをスクリーニングして比較した.その結果,LPSで活性化するほとんどのシェディングがTPAでも同等に活性化することがわかり,シェディングされる膜タンパク質の種類は刺激の種類ではなく細胞の種類によってほとんど決まっていることがわかった(10).この結果は,細胞外刺激が基質となる膜タンパク質に作用してシェディングを活性化するのではなく,酵素であるADAMファミリーを活性化していることを示唆していた.最近,シェディングを活性化するさまざまな細胞外刺激によってADAM17と特異的に結合するiRhom2という膜タンパク質の細胞内領域がリン酸化されること,iRhom2のリン酸化がシェディングの活性化に必要不可欠であることが報告された(11, 12).iRhom2の細胞内領域にはリン酸化されうるセリン/スレオニン残基が409アミノ酸中69個と高い頻度で存在しており,さまざまなキナーゼの基質となりうることから多様なシグナルの集約点にふさわしい.iRhom2のリン酸化がADAM17を活性化する分子機構は不明であるが,シェディングの活性化がADAMファミリーの活性化に集約するであろうという筆者の予想が証明された形となった.一方で,接着分子Mac-1(macrophage-1 antigen, integrin αMとβ2の複合体)のシェディングだけは,LPSでは活性化せずTPAでのみ活性化することもわかった(10).この結果はTPAがiRhom2のリン酸化以外の経路を介してMac-1のシェディングを活性化している可能性を示唆しており,今後解析を進めることで新たなシェディング活性化機構を解明できるのではないかと考えている.またiRhom2にはADAM17の基質の選別にかかわるという報告もあり(13),ADAM10とADAM17が切断する膜タンパク質の違いがiRhom2の働きでどの程度説明できるのか今後の研究が待たれる.
膜タンパク質のシェディング感受性はその生合成過程において規定される
シェディングスクリーニングには当初2D-DIGEを用いていたが,二次元電気泳動は解像度が低く同定できるシェディングの数が少ないと感じていた.そこでSILAC(stable isotope labeling using amino acids in cell culture)というプロテオーム解析方法を用いることにした.この方法は,一方の細胞のタンパク質をすべて安定同位体アミノ酸でラベルすることで,別の細胞のタンパク質と混ぜ合わせても質量分析装置で見分けられ量を比較できるという方法である.SILACを用いることで2D-DIGEでは検出できなかったシェディングが複数同定できたが,なかでも新しく同定できた接着分子CADM1(cell adhesion molecule 1)の解析から興味深いことが明らかとなった(14).
CADM1は免疫グロブリンスーパーファミリーに属する接着分子であり,接着にかかわる細胞外の免疫グロブリン様領域と膜貫通領域との間,まさにシェディングで切断される部分に選択的エキソンが挿入されることで複数のスプライシング変異体を生じる.そこでこれらのスプライシング変異体がシェディングされるか調べたところ,全長の3%にも満たない33塩基という短い第9エキソンが挿入されたスプライシング変異体だけがシェディングされる(=シェディング感受性である)ことがわかった.また CADM1は第9エキソンがコードする11アミノ酸配列の中ではなく直後でシェディングされることも明らかになり(14),第9エキソンが切断配列を挿入することでCADM1をシェディング感受性にするのではないことが示唆された.
それでは,この11アミノ酸はどうやってCADM1をシェディング感受性にしているのだろうか.筆者らは11アミノ酸の直前にO型糖鎖がつきうるスレオニン残基がクラスターを作っていることに着目し,11アミノ酸が挿入されずO型糖鎖のついたスレオニン残基が切断配列の直前にくると糖鎖がシェディングを阻害するのではないかと考えた.そこでシェディング耐性のCADM1(11アミノ酸なし)の切断配列直前のスレオニン残基を糖鎖のつかないアラニン残基に置換して,切断配列の直前に糖鎖のつかない6アミノ酸を作ったところ,それだけでシェディング感受性になることがわかった.一方,11アミノ酸を見てみると,前半の6アミノ酸はスレオニン残基が多いが切断配列直前の後半の5アミノ酸は糖鎖がつかない.そこで,この5アミノ酸が切断配列の直前に挿入されることでCADM1がシェディング感受性になるのではないかと考え,シェディング感受性のCADM1(11アミノ酸あり)から糖鎖がつかない5アミノ酸だけを欠失させたところシェディング耐性になることがわかった.さらにこの5アミノ酸の代わりに糖鎖がつかないアラニン残基を挿入するとシェディング感受性に戻ること,糖鎖がつくスレオニン残基を挿入するとシェディング耐性のままであることもわかった(14).これらの結果から,第9エキソンは糖鎖がつかない5アミノ酸を切断配列の直前に挿入し,酵素が入る隙間を作ることでCADM1をシェディング感受性にしていることが明らかとなった(図4).そしてこの研究により,CADM1のシェディング感受性が,核内で起こる選択的スプライシングとゴルジ体で起こる糖鎖修飾という2つの生合成過程を通じて規定されることが明らかとなった.
プロテオーム解析から見えてきたシェディングの特異性を決める分子機構
以上,筆者がこれまで行ってきたプロテオーム解析を用いたシェディング研究について紹介してきた.シェディングされる膜タンパク質全体を対象にした研究を行うことで,これまで見過ごされていた膜タンパク質のシェディングが同定できたり,細胞外刺激の違いがシェディングの活性化に集約される分子機構を推定できたりしただけでなく,膜タンパク質のシェディング感受性が選択的スプライシングや糖鎖修飾といった生合成過程において規定されるという分子機構を明らかにすることもできた.選択的スプライシングによってシェディング感受性を規定するという仕組みは,分子構造はほとんど同じだがシェディング感受性だけが異なる膜タンパク質を一つの遺伝子から作り出すことを可能にするだけでなく,シェディング感受性とシェディング耐性の膜タンパク質を細胞ごとに任意の割合で同時に作り出し膜に埋め込むことを可能にする.筆者らはスクリーニングで同定されたほかの膜タンパク質についてもスプライシング変異体ごとにシェディング感受性が異なることを明らかにしており(未発表データ),比較的多くの膜タンパク質のシェディング感受性が選択的スプライシングによって規定されているのではないかと考えている.細胞にすでに存在するスプライシング変異体の割合を変えるためには,それらのタンパク質を分解して新しいmRNAからタンパク質を作り出す必要があるので,細胞外刺激によるシェディングの活性化といった短時間(~1時間)の現象を選択的スプライシングの変化で説明するのは難しい.しかし,細胞の分化に応じて選択的スプライシングが変化することはよく知られており(15),受容体や接着分子のシェディング感受性/耐性の割合が変化することで細胞のシグナル応答能や細胞・細胞外基質との接着能が変化し,細胞の運命が決定づけられる可能性は十分に考えられる.今後,シェディング感受性を制御する選択的エキソンだけを欠失したマウスを用いることで,選択的スプライシングによるシェディング感受性制御の生体内での意義を明らかにしたいと考えている.
切断配列直前についた糖鎖がシェディングを阻害するという結果と,ほとんどの膜タンパク質が糖鎖修飾を受けるという事実を合わせると,シェディングの特異性を決める分子機構について新しい考え方が生まれるだろう.これまで漠然と想定されていたようにシェディングされやすいアミノ酸配列をもつものが積極的にシェディング感受性になるのではなく,ほとんどの膜タンパク質が糖鎖修飾で保護されシェディング耐性であるなかで,かろうじてADAMファミリーが入り込める隙間があるものがシェディングされているのではないだろうか.これまでシェディングの報告がある膜タンパク質にアミノ酸配列上の類似がないことや,ADAMファミリーの認識配列が比較的曖昧であることも,この考え方を支持するように思う.またわれわれの最近の研究から,切断配列近傍の酸性アミノ酸がシェディングを阻害する可能性も示唆されており(未発表データ),膜タンパク質をシェディングから保護する方法は糖鎖修飾だけではなさそうである.シェディングの影響力の強さを考えると,膜タンパク質は基本的にシェディングから保護されているという考え方は妥当に感じられる.
おわりに
ガンの発症にかかわる増殖因子EGFファミリー,炎症性疾患にかかわるサイトカインTNFα,神経変性疾患にかかわるアミロイド前駆体タンパク質など,疾患にかかわるさまざまな膜タンパク質がシェディングを受ける.なかでもTNFαの働きを抑える抗体医薬品がリウマチなどの慢性炎症性疾患に効果的であることはよく知られているが,抗体医薬品には投与方法(点滴や注射)の不便さや薬価の高さから患者の負担が大きいという問題がある.もしもTNFαのシェディングを低分子化合物で阻害することができれば,慢性炎症性疾患治療の救世主となる可能性が高いが,ADAMファミリー阻害剤の特異性の低さなどから実現には至っていない.筆者は,シェディングの制御機構を明らかにする基礎的な研究を通じて,シェディングがかかわるさまざまな疾患の新しい治療方法の構築に貢献できればと考えている.この解説が,若い皆さんがシェディングに興味をもち研究に参加するきっかけとなれば幸いである.
成果情報 シェディングされる膜タンパク質を選び出す仕組みを解明―負の電荷を持つアミノ酸がシェディングを阻害する―

掲載日 令和2年7月21日 最終更新日 令和2年7月21日
立命館大学
日本医療研究開発機構
立命館大学生命科学部の白壁恭子教授らの研究グループは、東京医科歯科大学、九州大学、大阪大学との共同研究で、膜たんぱく質の特定の領域のアミノ酸配列が細胞外ドメインシェディング(以下、シェディング)に対する感受性を決めていることを解明いたしました。本研究成果は、学術誌「Journal of Biological Chemistry」で発表し、採択率2%程度であるEditors' Picksにも選出されました。本研究は、国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域における研究開発課題「細胞間相互作用と臓器代謝ネットワークの破綻による組織線維化の制御機構の解明と医学応用」(研究開発代表者:小川佳宏)の一環で行われました。
本件のポイント
- 細胞膜に埋め込まれた膜タンパク質から細胞外ドメイン*1を切り離す「シェディング」は、切断されるタンパク質だけではなく、それを発現している細胞の機能も変換する影響力の強い分子機構です。
- 本研究では、細胞外ドメインの膜近傍に「負の電荷を持つアミノ酸」を多く含む膜タンパク質はシェディングを免れることを明らかにしました。
- シェディングが関わる炎症性疾患・がん・神経変性疾患といった様々な疾患の治療方法の開発に繋がる可能性があります。
研究分野の背景
細胞膜には様々な機能を持つ膜タンパク質が埋め込まれており、埋め込まれている膜タンパク質の種類によって細胞が果たせる機能も異なります。白壁教授らが研究の対象としているシェディングは、膜タンパク質から細胞外に露出している部分を切り離すという分子機構であり(図1)、細胞表面にある膜タンパク質のレパートリーを変えることで細胞の機能も変えてしまう、強い影響力を持った機構です。また炎症を惹起するサイトカインや細胞増殖を促す増殖因子には、膜タンパク質として作られシェディングされて初めて全身性に作用するものも多く、シェディングは細胞間コミュニケーションの根幹を支えています。シェディングは膜に埋め込まれた切断酵素*2(図1、ハサミ)によって担われますが、この酵素には特定のアミノ酸配列を認識して切断するといった性質はなく、どのようにして限られた膜タンパク質だけがシェディングされるのかはほとんどわかっていませんでした。
成果の要点
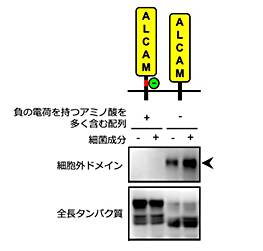
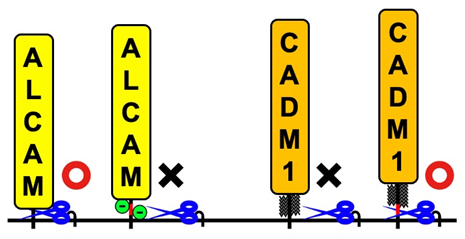
免疫細胞マクロファージが細菌成分を認識して活性化すると、炎症性サイトカインがシェディングされ放出されます。これまでの研究で白壁教授らは、活性化したマクロファージからシェディングされ放出される膜タンパク質をプロテオミクススクリーニングすることで、接着分子ALCAM(activated leukocyte cell adhesion molecule)がシェディングされることを明らかにしていました。本研究では、選択的スプライシングによって生じる2種類のALCAMバリアント*3の解析から、予期しなかったシェディング制御機構を明らかにすることができました。この2つのALCAMバリアントは、シェディングが起こる膜近傍に分子全体の3%にも満たない短いアミノ酸配列(図2上、赤線)が挿入されるか否かで生じますが、挿入されたALCAMはシェディングされず挿入されないALCAMはシェディングされることがわかりました(図2)。この短い配列にはシェディングを阻害する何らかの要素が含まれると考え詳細に解析したところ、配列の半分近くが負の電荷を持つアミノ酸(図2上、緑丸)であること、これらの負の電荷を持つアミノ酸を電荷のないアミノ酸に置換するとシェディングされるようになることがわかりました。白壁教授らは既にCADM1(cell adhesion molecule 1)という別の接着分子について、シェディング切断部位に糖鎖のないCADM1バリアントだけがシェディングされることを報告しています。今回の結果と合わせて考えると、シェディングを担う切断酵素にとって好ましい要素を持つ膜タンパク質が選ばれるのではなく、「阻害要素がない膜タンパク質」が選ばれることでシェディングの特異性が保たれているという、シェディング制御機構の新しい考え方が示唆されます(図3)。
細菌成分を認識すると切断酵素が活性化するが負の電荷を持つアミノ酸があると切断されない
今後の展開と社会へのインパクト
シェディングされる膜タンパク質には炎症の惹起やがんの発症に関わるものもあります。またアルツハイマー型認知症の原因となる膜タンパク質もシェディングされ脳に蓄積することが知られています。シェディングがどういう時に起こって、どういう時に起こらないのか、という制御機構を明らかにすることでこれらの疾患に対する新しい治療方法が構築できるかもしれません。特に、シェディング酵素が負の電荷を嫌うという今回の発見は、何らかの方法で細胞表面に負の電荷をもたらすことでシェディングを抑えられる可能性を示唆しています。現在猛威を奮っている新型コロナウイルスも、全身性の炎症反応の暴走が重篤化の原因と考えられています。シェディングの阻害方法を確立することで様々な疾患の治療方法の構築に貢献できればと考えています。
用語の解説
- *1 細胞外ドメイン
- 脂質でできた細胞膜には様々なタンパク質が埋め込まれており、埋め込まれるタンパク質の種類によって細胞の機能は異なります。膜に埋め込まれたタンパク質のうち細胞外に露出した部分を細胞外ドメインと呼び、細胞と外界とのインターフェイスとしての機能を担っています。
- *2 切断酵素
- シェディングを主に担っているのは、細胞外に活性中心を持つ膜貫通型のタンパク質分解酵素(プロテアーゼ)、ADAM(a disintegrin and metalloprotease)ファミリーです。今回の研究でADAMファミリーには「膜から決まった距離で切断する」という性質があることもわかりました。ADAMファミリーが切断しやすいところにシェディングを阻害する要素があるかどうかで、その膜タンパク質がシェディングされるかどうかが決まると考えています。
- *3 バリアント
- 遺伝子はタンパク質の設計図となる複数の「エキソン」が、タンパク質にならない「イントロン」で挟まれた構造をしています。このエキソンが取捨選択されることを選択的スプライシングと呼び、選択的スプライシングの結果として、一つの遺伝子から作られるエキソンの構成が異なるタンパク質をバリアントと呼びます。
論文情報
- 雑誌名:
- Journal of Biological Chemistry
- 論文名:
- Negatively charged amino acids in the stalk region of membrane proteins reduce ectodomain shedding
- 執筆者名(所属機関名):
- Iwagishi R.1, Tanaka R.1, Seto M.1, Takagi T.1, Norioka N.2, Ueyama T.1, Kawamura T.1, Takagi J.2, Ogawa Y.3,4,5 and Shirakabe K.1,3
(立命館大学1、大阪大学2、東京医科歯科大学3、九州大学4、AMED-CREST5)
白壁教授はR-GIRO、システム視覚科学研究センターの一員です。 - DOI:
- 10.1074/jbc.RA120.013758
本件に関するお問合せ先
立命館大学に関すること
立命館大学広報課 担当:名和
TEL:075-813-8300
E-mail:nawataku“AT”st.ritsumei.ac.jp
AMED 事業に関すること
国立研究開発法人日本医療研究開発機構(AMED) シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
補足:コードの解説
関数などの説明を覚え書きように記載(入力するショートコードは[s-text id=591])
function text_insert($atts){
extract(shortcode_atts(array("id"=>0),$atts));
if(get_post($id)!=null)
return wpautop(do_shortcode(get_post($id)->post_content));
}
add_shortcode("s-text","text_insert");
・function 作成する関数名(引数){
処理
}
・shortcode_atts 第一引数でデフォルトの属性と値設定、第二引数は入力されたidの値(591)
・extract 新しい変数を作成(ここでは $id = 591)
if文
・idが空でない場合、指定idのコンテンツを返す
・wpautop wordpressの自動整形関数
add_shortcode関数
・add_shortcodeはショートコードタグを追加する関数
・引数”s-text”はショートコードとして呼び出す文字 [s-text id=591]のs-text
・”text_insert”は1行目で作成した関数を呼び出している


コメント